|
¿Qué es un canal iónico?
Función de los canales iónicos
Estructura de los canales iónicos
Tipos de canales iónicos
Estados conformacionales de un canal iónico
Canalosoma
Referencias
¿Qué es un canal iónico?
La membrana celular ejerce el papel de barrera que separa dos medios acuosos de distinta composición, el extracelular y el intracelular, regulando su composición. La mayoría de los fármacos y solutos liposolubles, cuando no están ionizados, atraviesan directamente la membrana celular por un proceso de difusión pasiva, que facilita el paso desde el medio donde se encuentra más concentrada a aquel en el que se encuentra más diluida. A la diferencia de concentración entre los dos medios se la denomina gradiente de concentración, y la difusión continuará hasta que este gradiente haya sido eliminado. Según la ley de Fick, la velocidad de este proceso será tanto más rápido cuanto mayor sea el gradiente de concentración y la liposolubilidad de la molécula y menor sea el tamaño de ésta.
Las moléculas más hidrofílicas, como los iones, son inmiscibles en los lípidos de la membrana y para atravesarla requieren de mecanismos específicos de transporte. En algunos casos, los iones pasan a través de poros hidrofílicos denominados canales iónicos, y en otros se transportan a favor de su gradiente de concentración uniéndose a proteínas transportadoras o carriers. Ambos sistemas de transporte son pasivos y, por tanto, no consumen energía obtenida a partir de la hidrólisis del ATP producido por el metabolismo celular. Otras veces, el transporte de iones se realiza contra un gradiente electroquímico, desde la zona más diluida a la más concentrada, utilizando unas proteínas denominadas bombas iónicas. Esta forma de transporte es activa y requiere el gasto de energía procedente del metabolismo energético celular, que se obtiene, generalmente, de la hidrólisis del ATP. Todos estos mecanismos de transporte activo son responsables de la distribución asimétrica de iones a ambos lados de la membrana celular.
Sin embargo, la forma más eficiente de mover iones a través de la membrana celular es a través de los canales iónicos, el flujo de iones a su través a una velocidad muy superior a la de cualquier otro sistema biológico (108 iones/seg frente a 103 iones/seg de un transportador). El flujo de iones que atraviesa cada canal puede medirse como una corriente eléctrica, que es capaz de producir rápidos cambios en el potencial de membrana.
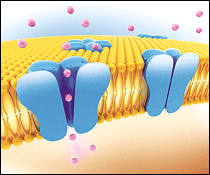
Función de los canales iónicos
El potencial de acción celular que permite al cerebro pensar, al corazón latir y al músculo contraerse, es el resultado de una serie de cambios secuenciales reversibles en la conductancia de la membrana a distintos iones producidos en respuesta a cambios en el potencial eléctrico entre la célula y el medio que la rodea. Los iones son moléculas hidrofílicas que atraviesan la bicapa lipídica-hidrofóbica a través de estructuras especializadas, los poros o canales iónicos.

¿Qué es un canal iónico? Los canales iónicos son proteínas integrales transmembrana oligoméricas (es decir, que están formadas por el ensamblaje de varias subunidades) que, en respuesta a un estímulo adecuado forman un poro hidrofílico, que comunica los espacios intra y extracelular y permite el rápido paso a su través de determinados iones a favor de gradiente de concentración y de potencial eléctrico (gradiente electroquímico) generando una corriente iónica.
Los canales constan de una subunidad que en respuesta a un estímulo adecuado forma un poro hidrofílico que comunica los espacios intra y extracelular y permite el rápido paso a su través de determinados iones a favor de su gradiente electroquímico generando una corriente iónica
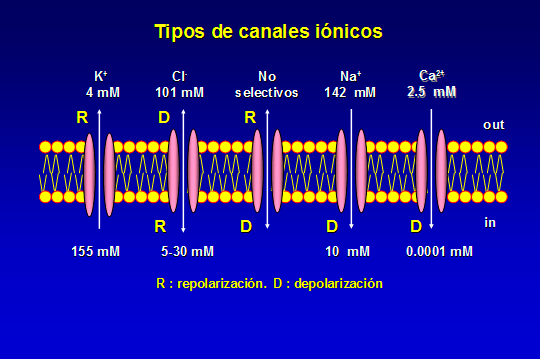
La difusión de iones a través de los canales iónicos de la membrana depende de su gradiente electroquímico y de la facilidad con la que los iones pueden pasar a su través, es decir, de la permeabilidad iónica de la membrana. En condiciones fisiológicas, los iones Na+ ([Na+]o = 160 mM vs [Na+]i = 6 mM) y de Ca2+ ([Ca2+]o = 2.5 mM vs [Ca2+]i = 0.0001 mM) se mueven hacia el interior de la célula, generando una corriente de entrada que despolariza la membrana. Por el contrario, la salida de iones K+ ([K+]o = 4 mM, [K+]i = 155 mM) hacia el medio extracelularo y la entrada de iones Cl hacia el interior celular ([Cl]o = 101 mM, [Cl]i = 5-30 mM) facilitan la repolarización celular y que el potencial de membrana alcance los niveles del potencial de reposo.
Figura. Los canales iónicos son proteinas estructurales de la membrana celular que permiten el paso de iones a su través.
No obstante, la expresión de los canales iónicos no se circunscribe sólo al sarcolema de las células excitables, sino que también se localiza en las membranas internas (p.ej. del retículo sarcoplásmico, lisosomas, endosomas, mitocondrias) de casi todas las células.
estos canales juegan un importante papel en la regulación del transporte transepitelial de agua y sales y del volumen y pH celulares y actúan como vías de señalización celular. Los canales localizados en la superficie del retículo sarcoplásmio, como el receptor de rianodina (RyR2), desempeñan un papel clave en en la cinética intracelular del Ca2+. Otro tipo de canales se encuentran en las uniones estrechas o gap junctions que permiten la comunicación directa entre células adyacentes a través de la difusión de iones, metabolitos y pequeñas moléculas de señalización. En el caso de los canales intercelulares cada célula aporta un conexón o semicanal (formado por 6 connexinas) localizado en la superficie de la membrana, formándose un canal que permite un acoplamiento eléctrico y metabólico entre células contiguas. La comunicación célula-célula de las conexinas (Cx) mediada por las conexinas es crucial en la propagación de los impulsos cardíacos.
En resumen, los canales iónicos son responsables de la transmisión del impulso eléctrico y mecánico a través de los miocitos cardíacos.
Estructura de los canales iónicos
Los canales iónicos cardiacos de Na+, Ca2+ o K+ son complejos heteromultiméricos formados por el ensamblaje de varias proteínas que se encuentran embebidas total o parcialmente en la membrana a las que denominamos subunidades. Los canales constan de una subunidad alfa que forma el poro hidrofílico que comunica los espacios intra y extracelular y permite el rápido paso de iones a través de las, que se ensambla con otras “subunidades accesorias o auxiliares” y con otras proteínas que interactúan con las proteínas formadoras del canal o que regulan su actividad.
Sin embargo, los canales iónicos no son simples poros acuosos conductores, sino que, presentan (Figura):
1) Un filtro de selectividad, que determina que ión que se mueve a su través. El mecanismo de selectividad se basa tanto en el tamaño del ión en su forma hidratada como en su carga, de modo que ciertos residuos del canal se alinean en el poro e interaccionan con los iones, formando barreras termodinámicas que favorecen el paso de un determiando ión. Así los canales de K+, son 10000 veces más permeables para el K+ que para el Na+. En general, el poro de los canales voltaje-dependientes es altamente selectivo para un determinado ión, mientras que los activados por receptores presentan menor selectividad y pueden, en muchos casos, conducir diversos cationes a su través.
2) Compuertas ("gates") que se abren o se cierran en respuesta a estímulos externos y controlan la permeabilidad del canal. En respuesta a diversos estímulos, las proteínas del canal son capaces de adoptar diversos estados o conformaciones estructurales. Los canales activados por cambios de voltaje presentan, al menos, un estado conductor (estado abierto o activo) y dos no-conductores (estados inactivo y de reposo).
3) La apertura y cierre de los canales iónicos es controlada por un sensor eléctrico, químico o mecánico. En los canales activados por cambios voltaje el sensor está determinado por varios aminoácidos con carga positiva que se localizan en el segmento S4, que actúa como un dipolo eléctrico y en los segmentos S1-S3. Durante la despolarización celular el segmento S4 se mueve a través de la membrana, cambiando la estructura terciaria del canal. El movimiento del sensor de voltaje crea un movimiento de cargas (llamado corriente de compuerta o de gating) que cambia la energía libre que modifica la >estructura terciaria del canal abriéndolo o cerrándolo.
Tipos de canales iónicos
Atendiendo a sus propiedades cinéticas (activación-inactivación), características farmacológicas y al estímulo que determina el cambio conformacional, podemos clasificar los canales iónicos en:
1. Canales activados por cambios de voltaje o canales voltaje-depencientes. Son aquéllos que modulan su estado (abierto o cerrado) en respuesta a cambios en el potencial eléctrico a través de la membrana. Su principal función es la generación de potenciales de acción y su propagación de los potenciales de acción a través del miocardio.
2. Canales activados tras la interacción de un agonista con su receptor específico localizado en la superficie de la membrana celular. Son los canales activados por receptores/ligandos (Receptor- or ligand-activated channels). En este caso, la unión de determinados neurotransmisores, hormonas o fármacos a su receptor localizado en la superficie de la membrana celular provoca la apertura del canal. Estos canales son importantes en la transmisión sináptica. En estos canales la apertura del canal se produce: a) tras la unión del neurotransmisor al receptor asociado al canal (receptores ionotrópicos, receptores activados directamente). b) Tras la unión del ligando a un receptor que no está asociado al canal. Esto provoca la activación de vías de señalización (proteínas G, forforilación protéica) que determinan la apertura del canal. En estos canales el sensor es una región de la proteína canal que se encuentra en el exterior o interior de la membrana, que une con gran afinidad una molécula específica que lleva a la apertura o cierre al canal.
3. Canales activados por mediadores intracelulares (Ca2+, ATP, proteínas G, nucleótidos cíclicos, proteínas quinasas, ácido araquidónico y sus derivados).
4. Canales activados por factores físicos (estiramiento o deformación de la membrana, cambios de presión, temperatura o el pH, aumento del volumen celular). El mecanismo sensor de estos canales es desconocida, aunque los ácidos grasos de la membrana o el citoesqueleto pueden estar involucrados.
5. Canales de goteo o "Leak channels", que se abren y cierran espontáneamente.
Sin embargo, muy a menudo esta división de los canales iónicos es artificial, ya que la despolarización de la membrana también puede producir la liberación de ligandos endógenos y activar los canales activados por receptores o mediadores intracelulares, mientras que muchos ligandos endógenos también pueden modificar el potencial de membrana y activar canales voltaje-dependientes.
Estados conformacionales de un canal iónico
Los canales iónicos activados por cambios de voltaje pueden adoptar durante el potencial de acción tres estados conformacionales: un estado conductor (abierto-O o estado activo) y dos no-conductores (inactivos-I y los estados de reposo R). El estado de reposo-cerrado no permite el paso de los iones, pero que pueden abrirse en respuesta a un estímulo específico. El estado abierto permite el paso de iones a su través, generando una corriente iónica (eléctrica) a través de la membrana. A nivel del potencial de reposo cardiaco, la probabilidad de apertura de algunos canales es mínima, es decir, que sólo un reducido número de canales puede abrirse al azar, pero sí pueden abrirse en respuesta a un estímulo adecuado. La despolarización celular produce la activación del canal, pero si la despolarización se mantiene, la probabilidad de apertura del canal disminuye como consecuencia del proceso de inactivación iniciado simultáneamente por el proceso de activación. Así el canal pasa al estado inactivo-cerrado desde el que el canal no puede volver a abrirse. Para que la apertura tenga lugar el canal debe volver al estado de reposo. Este paso del estado inactivo al de reposo, se denomina reactivación del canal y se produce durante la repolarización celular. Por tanto, la magnitud de la corriente que cruza la membrana depende de la densidad de canales, la conductancia del canal abierto y de cuánto tiempo el canal permanece en el estado abierto.
En un modelo de canal iónico activado por cambios de voltaje con dos compuertas (una compuerta de activación y otra de inactivación) ambas deben estar abiertas para que los iones puedan ser conducidos a través del canal. La apertura de la compuerta de activación ocurre durante la despolarización celular. La desactivación es el proceso opuesto, es decir, el cierre de la compuerta en respuesta a que el voltaje del interior celular se hace más negativo (repolarización). La inactivación es el cierre de la compuerta de inactivación que, al igual que la activación, ocurre en respuesta al hecho de que el voltaje dentro de la membrana se vuelve más positivo. La recuperación de la inactivación es lo opuesto a la inactivación. Por tanto, la inactivación y la desactivación hacen que disminuya la conductancia del canal, pero se diferencian en cuanto la inactivación se produce cuando el interior de la membrana se vuelve más positivo y la desactivación cuando el potencial de la membrana se vuelve más negativo.
Canalosoma
El concepto clásico que hemos mencioando consideraba que los canales iónicos cardiacos son complejos heteromultiméricos formados por el ensamblaje de la subunidad α, que forma el poro hidrofílico, con una o más subunidades auxiliares. Sin embargo, en los últimos años se ha hecho evidente que aunque el ensamblaje de las subunidades a puede formar un canal funcional, en la mayoría de los casos, el correcto funcionamiento del mismo requiere su localización específica en una zona determinada del sarcolema, su anclaje al citoesqueleto y/o su unión a proteínas que actúan de plataformas (scaffold proteins) y que ponen en relación al canal con otros canales, receptores o enzimas. Este conjunto de proteínas constituyen un “canalosoma” y representa la unidad estructural y funcional del canal iónico.
Referencias
Hille B. Ion channels of excitable membranes. Hille B (Ed.). 2001.
Payandeh J, Scheuer T, Zheng N, Catterall WA. The crystal structure of a voltage-gated sodium channel. Nature. 2011;475:353-358.
Cardiac Electrophysiology. Eds. Zipes DP, Jalife J. Elsevier. Estados Unidos. 7th Edition. 2017.
|
 Web de Interes Sanitario
Web de Interes Sanitario



