Potencial de acción cardiaco
|
Potencial de acción cardiaco Las células musculares cardiacas (cardiomiocitos) son células excitables que en respuesta a un estímulo generan un potencial de acción (PA) asociado a una respuesta contráctil. Un PA es un cambio reversible en el potencial de membrana producido por la activación secuencial de diversas corrientes iónicas generadas por la difusión de iones a través de la membrana a favor de su gradiente electroquímico. Así, durante la despolarización el interior celular pasa de estar cargado negativamente (»-85 mV) a estarlo positivamente (alcanzando +20 ó +30 mV) para posteriormente recuperar de nuevo los -85 mV durante el proceso de repolarización celular.
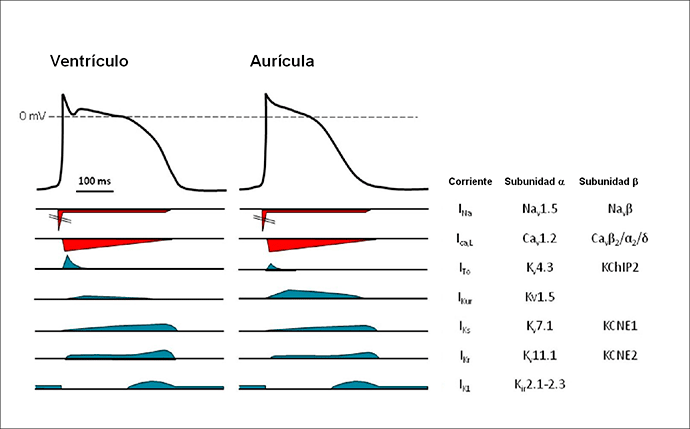
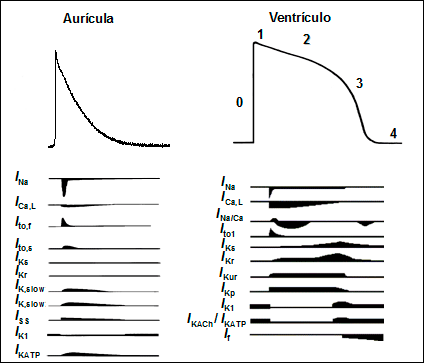
Figura 1: Corrientes iónicas implicadas en la génesis de los PA auriculares y ventriculares y las subunidades α y β que las forman. La scorrientes despolarizantes se muestran en color rojo y las despolarizantes en color azul. Al comparar la morfología de los PAs auriculares y ventriculares, se observa que la DPA es mayor en las células ventriculares, lo que constituye un mecanismo protector que evita que éstas puedan responder a frecuencias auriculares muy rápidas o a una estimulación prematura del corazón. Adaptada de Tamargo et al., 2006.
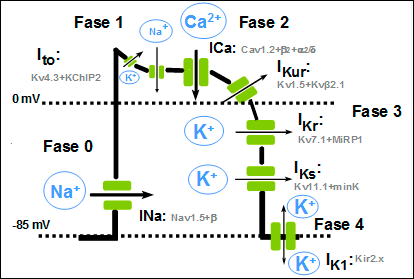
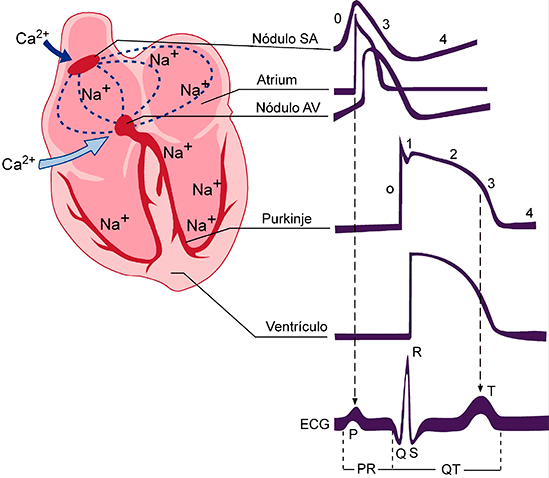
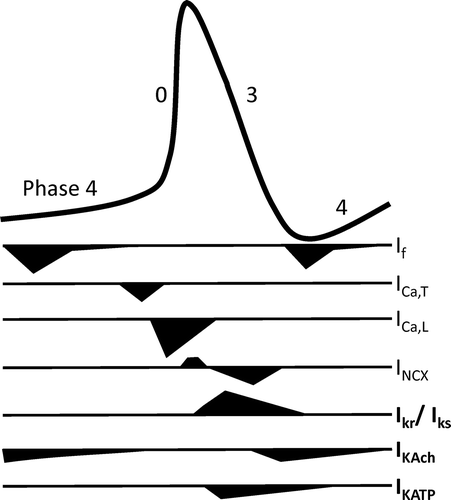
Figura 2. Representación esquemática de las distintas fases de un PA ventricular y las diversas corrientes iónicas de entrada y salida, así como las subunidades y las subunidades reguladoras que forman los diversos canales. Una vez repolarizada la célula, el Em permanece estable hasta que la célula es despolarizada de nuevo. A esta fase entre dos PA se le denomina fase 4 y se corresponde con la diástole. En células musculares auriculares y ventriculares, que no son automáticas, esta fase es isoeléctrica y durante la misma se restituyen las concentraciones iónicas a ambos lados de la membrana gracias a la activación de: a) la ATPasa dependiente de Na+/K+ (salida de 3 Na+, entrada de 2 K+) que, debido a su naturaleza electrogénica, genera una corriente hiperpolarizante que participa en la fase 3 de repolarización y en el mantenimiento del potencial de reposo. b) El intercambiador Na+-Ca2+; (NCX1: 3Na+:1Ca2+;). La dirección del movimiento de estos iones (hacia adentro o hacia afuera) depende del potencial de membrana y el gradiente iónico. Cuando el potencial de membrana es negativo (p.ej., durante las fases 3 y 4 del AP), el NCX1 transporta Ca2+; hacia fuera y facilita la entrada de Na+ al interior celular, mientras que cuando la célula se despolariza (fases 0, 1 y 2 de la AP), el intercambiador funciona en la dirección opuesta (es decir, el Na+ sale de la célula y el Ca2+; entra en la célula). Es decir, que el NCX1 también contribuye a la entrada de Ca2+; durante la fase de meseta de la AP. Relación entre el potencial de acción y el electrocardiograma. Las fases del potencial de acción cardiaco se corresponden con las del electrocardiograma (ECG) (Figura 3). La onda P refleja la despolarización (fase 0) auricular, el complejo QRS la despolarización ventricular, el intervalo PR refleja la velocidad de conducción a través del nódulo AV, el complejo QRS la velocidad de conducción intraventricular y el intervalo QT la duración del potencial de acción ventricular. El ensanchamiento del complejo QRS refleja una reducción en la velocidad de conducción intraventricular que generalmente resulta de una inhibición de la INa; la elevación del segmento ST refleja los gradientes de voltaje transmural durante lafase de meseta del AP, un sello del síndrome de Brugada. Figura 3. Representación esquemática de los potenciales de acción registrados en diversos tejidos cardíacos según la secuencia de activación y su correlación con el electrocardiograma de superficie. También se muestran los tejidos que generan PA Ca2+;-dependientes (nódulos SA y AV) y Na+-dependientes (aurículas, ventrículos y sistema His-Purkinje. SA: nódulo senoauricular. A-V: nódulo aurículo ventricular. Actividad eléctrica de las células marcapaso Aunque todas las células cardiacas son excitables y responden a un estímulo con una respuesta contráctil, algunas células son automáticas, es decir, que generan de forma espontánea sus PA. La actividad eléctrica en el corazón humano se origina en las células marcapasos especializados ubicados en el nódulo sinoauricular (NSA). Los PA de estas células no presentan un potencial diastólico isoeléctrico, sino que durante la diástole presentan una fase de lenta despolarización que desplaza el potencial de membrana hacia el potencial umbral y cuando éste se alcanza se genera un nuevo PA propagado. La inclinación de esta fase de lenta despolarización determina la frecuencia del latido cardiaco.
Cuando el potencial de membrana de las células del nódulo SA alcanza el potencial diastólico máximo, la conductancia al K+ disminuye y las corrientes de entrada despolarizantes (If e ICaL) aumentan, lo que induce la aparición de una fase de lenta despolarización diastólica espontánea. La despolarización del potencial de membrana facilita la liberación de Ca2+; desde el RS y genera una señal de Ca2+; que activa la INCX. Ello da como resultado un aumento de la entrada de Na+ a través del NCX que conduce a una despolarización de la membrana durante el intervalo diastólico tardío y acelera el tiempo para alcanzar el potencial de umbral.
Figura 4. Corrientes iónicas que participan en la génesis de la PA generado en el las células del nódulo sinoauricular (tomado de Aziz yTinker, 2018). Aziz Q, Li Y, Tinker A. Potassium channels in the sinoatrial node and their role in heart rate control, Channels 2018;12:356-366. Kleber A, Rudy Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiol Rev. 2004;84:431-488. Matteo E, Nargeot J. Genesis and regulation of the heart automaticity. Physiol Rev 2008;88:919-82. Nerbonne JM, Kass RS. Molecular physiology of cardiac repolariation. Physiol Rev 2005;85:1205-1253. Tamargo J., Delpón E. Pharmacologic bases of antiarrhythmic therapy. Chapter 54. En: Cardiac Electrophysiology. Eds. Zipes DP, Jalife J, Stevenson WG. Elsevier. Estados Unidos. 8th Edition. 2017. pp. 513-524. Tamargo J. Fármacos antiarrítmicos. En: Farmacología Humana (6ª edición). Ed.: Jesús Flórez. Elsevier Masson. Barcelona 2013:615-632. Tsutsui K, Monfredi OJ, Sirenko-Tagirova SG, et al. A coupled-clock system drives the automaticity of human sinoatrial nodal pacemaker cells. Sci Signal. 2018;11: eaap7608. |
 Web de Interes Sanitario
Web de Interes Sanitario
|
| Aviso legal Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional |