Síndromes de repolarización temprana (SRT)
El complejo QRS del ECG se corresponde con la despolarización ventricular y el segmento ST con la fase final de la despolarización ventricular. La onda J representa la unión del complejo QRS con el comienzo del segmento ST del ECG, que normalmente debe ser isoeléctrico y corresponde a la transición de la despolarización ventricular hacia la repolarización en el ECG de superficie. Se considera que la elevación del punto J refleja las diferencias transmurales en las primeras fases del potencial de acción (Antzelevitch et al., 2013). ¿Qué es el síndrome de repolarización precoz? En un reciente informe de consenso (McFarlane et al., 2015), el SRT se reconoce si se dan los siguientes criterios:
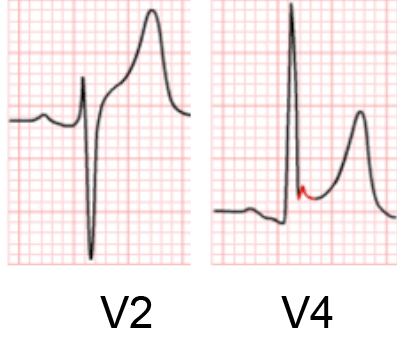
Se conocía como repolarización precoz un patrón electrocardiográfico caracterizado por elevación del segmento ST que se inicia al final del QRS y el comienzo del ST (punto J) el cual tiene una concavidad superior y se acompaña de ondas T altas y asimétricas en las derivaciones V2-V4. Dado que la elevación del punto J en derivaciones inferiores aparecía con frecuencia en el ECG de individuos sanos, físicamente entrenados y con frecuencias cardíacas lentas durante muchos años se la consideró como un marcador de “buena salud”.
La prevalencia del patrón de RT aparece en hasta el 13% de la población general, y es mayor en niños, hombres, deportistas y afroamericanos (Tikkanen et al., 2009; Sinner et al., 2010; Wu et al., 2013). En una población de 10.864 sujetos de mediana edad (media 44 años), el patrón de repolarización temprana de ≥0.1 mV aparecía en 630 sujetos (5.8%) (Tikkanen et al., 2009). Sin embargo, en un estudio realizado en jóvenes deportistas sanos de Finlandia y Estados Unidos, la repolarización temprana aparecía en el 44% de los atletas finlandeses y en el 30% de los atletas estadounidenses (Tikkanen et al., 2011; Rosso et al., 2008). La alta prevalencia de ER en atletas no implica un mayor riesgo de eventos arrítmicos, ya que la probabilidad de muerte arrítmica es de aproximadamente 0.35:100.000 en atletas competitivos (Cappato et al., 2010). Por lo tanto, no es razonable recomendar la suspensión del deporte en atletas asintomáticos. Correlación entre el punto J y la MSC.
En un 1-5% de la población general y un 15-70% de los pacientes con FV idiopática aparece en el ECG una elevación del intervalo ST no secundaria a un evento isquémico, que empieza al final del QRS y al comienzo del ST (punto J ≥ 0.1 mV), asociado a una muesca al final del QRS y ondas T altas y asimétricas en V2-V4 (Haissaguerre et al., 2008; Haruta et al., 2011; Nam et al., 2008; Rosso et al., 2008, 2011; Sinner et al., 2010). Evidencias recientes indican que la presencia de repolarización precoz aumenta 2-6 veces el riesgo de MSC por causas cardiovasculares en individuos entre 35 y 54 años de edad (Haissaguerre et al., 2008; Haruta et al., 2011; Nam et al., 2008; Rosso et al., 2008, 2011; Sinner et al., 2010). Por otra parte, en pacientes con una tormenta eléctrica ventricular la única señal premonitoria en el ECG es la presencia de RT y una acentuación de las ondas J en las derivaciones infero-laterales y el desarrollo de marcadas ondas J o de una elevación del segmento ST en las derivaciones precordiales derechas justo antes de la aparición de la TV/FV y la arritmia es iniciada por la aparición de un latido ventricular prematuro con un intervalo de acoplamiento corto. Clasificación de los síndromes de repolarización temprana
Antzelevich y Yan (2010) propusieron clasificar el patrón ECG del SRT en tres subgrupos: Bases fisiopatológicas
La onda J se origina a partir de la distribución heterogénea de la corriente de salida transitoria de K+ (Ito) responsable de la morfología de punta-cúpula del AP a través de la pared ventricular. El PA epicárdico, en particular en el ventrículo derecho, presenta una muesca marcada debido a la activación de Ito, que le confiere la típica morfología de pico-cúpula. Esta muesca no está presente en el endocardio ventricular, lo que crea un gradiente de voltaje transmural que da lugar a una onda J o elevación del segmento ST en el ECG (Antzelevitch, 2012). Un aumento en la corriente neta repolarizante, ya sea debida a una reducción de las corrientes de entrada o a un aumento en las corrientes de salida acentúa la muesca, aumenta la amplitud de la onda J o eleva el punto J en el ECG (Yan y Antzelevitch, 1999). En pacientes con SRT las células epicárdicas se han repolarizado por completo cuando las restantes células ventriculares aún se encuentran en la fase de meseta; ello que crea un gradiente de corriente desde la zona despolarizada hasta la que ya se ha repolarizado, mecanismo por el que se produce la elevación del segmento ST. Bases genéticas El SRT se transmite con un patrón de herencia autosómica dominante con penetrancia incompleta. La transmisión familiar es más frecuente cuando la madre se ve afectada. Las posibles explicaciones de esta transmisión incluyen la transmisión a través del ADN mitocondrial, los efectos mediados por los cromosomas sexuales y la impronta parental de los genes autosómicos. Las formas malignas familiares del SRT excepcionalmente raras. Aunque desconocemos las bases genéticas del SRT, se han identificado mutaciones en varios genes que conducen a un aumento neto de las corrientes repolarizantes, ya sea por disminuir la INa o la ICa o aumentar las corrientes de salida de K+ IKATP y IKACh (Antzelevitch 2012,2016). Mutaciones con ganancia de función en el gen KCNJ8 que codifica una subunidad α de los canales KATP que presenta rectificación interna y son activados por ATP aumentan la corriente de salida de K+ se han identificado en pacientes con SRT y VF idiopática (Medeiros-Domingo et al., 2010, Haisseguerre et al., 2009; Watanabe et al. al., 2011; Barajas-Martínez et al., 2012).
El SRT también se asocia a mutaciones con pérdida de función en los genes CACNA1C, CACNB2 y CACNA2D1 que codifican las subunidades α, β2 y δ de los canales tipo L de Ca2+ (Burashnikov et al., 2010) y en los genes SCN5A y SCN10A que codifican la subunidad α de los canales Na+ (Watanabe et al., 2011). Recientemente, se ha identificado una variante rara [sustitución del ácido aspártico (D) por el ácido glutámico (E) en la posición 5 en el exón 1b en el N-terminal de DPP10] en el gen KCND2 que codifica el canal Kv4.2 en un paciente con ondas J en las derivaciones precordiales derechas (Perrin et al., 2014). La coexpresión del KCND2 mutante y salvaje con KChIP2 en células HEK293 demostró un fenotipo de ganancia de función, que incrementaba en un 48% el pico de la corriente Ito del 48%. Un raro polimorfismo en el extremo N-terminal de DPP10 retarda la inactivación y la recuperación de la inactivación de la Ito y aumenta notablemente la densidad de corriente Kv4.3. Quinidina y cilostazol inhibían la Ito en aproximadamente el 50% en los canales mutantes, pero menos (20%) en los canales nativos (Barajas-Martínez et al., 2012). Diagnóstico No existen criterios definidos y validados para el diagnóstico del SRT. Sin embargo, en el ECG de los pacientes con SRT se pueden observar una elevación del punto J ≥ 1 mV en las derivaciones precordiales (V1-V3), ondas T positivas altas y asimétricas y depresión y/o acortamiento del segmento PR. Si el SRT se asocia a un antecedente de síncope, arritmia ventricular o historia familiar de MSC se debe realizar un ecocardiograma para descartar cardiopatía estructural y estudios electrofisiológicos no invasivos (ECG Holter, ECG de esfuerzo) para estratificar el riesgo arrítmico del paciente. Sin embargo, y en contra de lo que sucede en el SBr, la administración i.v. de flecainida no induce alteraciones en el ECG o proarritmia. Recientemente, Antzelevitch et al (2016) han desarrollado un algoritmo para el diagnóstico del SRT que se muestra en la Tabla.
No disponemos de una estratificación de riesgo para la RT en la población general o en familias con SRT (Priori et al., 2015). Los fármacos antiarrítmicos del grupo IC, amiodarona, mexiletina, verapamilo y β-bloqueantes tienen un pobre papel en el tratamiento de las arritmias del SRT. En pacientes con patrón RT que permanecen asintomático, el riesgo de arritmias ventriculares malignas es bajo y, por lo general, no requieren intervención. Se recomienda la implantación de un DAI en cualquier individuo con un historial de paro cardíaco resucitado o TV/FV documentada con o sin síncope. Las recomendaciones de consenso en pacientes del SRT son las siguientes (Priori et al., 2013):
Los eventos arrítmicos y la MSC en pacientes con SRT generalmente ocurren durante el sueño o en reposo y se asocian con frecuencias cardíacas lentas, lo que sugiere la posible utilidad de un marcapasos cardíaco. Debido a que las arritmias ventriculares malignas son infrecuentes en pacientes asintomáticos con SRT (Tikkanen et al., 2009) y por lo general no están relacionadas con la actividad física, la presencia de patrones ECG no contraindica su participación en la práctica de deportes, pero no hay datos clínicos suficientes para hacer recomendaciones sobre la práctica deportiva. Skinner JR, Winbo A, Abrams D, et al. Channelopathies That Lead to Sudden Cardiac Death: Clinical and Genetic Aspects. Heart Lung Circ. 2019;28:22-30. Aizawa Y, Chinushi M, Hasegawa K et al. Electrical storm in idiopathic ventricular fibrillation is associated with early repolarization. J Am Coll Cardiol 2013;62:1015–1019. Antzelevitch C, Yan GX. J wave syndromes. Heart Rhythm 2010;7:549-558. Antzelevitch C. Genetic, molecular and cellular mechanisms underlying the J wave syndromes. Circ J 2012;76:1054-1065. Antzelevitch C. J wave syndromes: molecular and cellular mechanisms. J Electrocardiol. 2013;46:510–518. Antzelevitch C, Yan GX, Ackerman MJ, et al. J-Wave syndromes expert consensus conference report: Emerging concepts and gaps in knowledge. J Arrhythm. 2016;32:315-339. Barajas-Martínez H, Hu D, Ferrer T, et al. Molecular genetic and functional association of Brugada and early repolarization syndromes with S422L missense mutation in KCNJ8. Heart Rhythm 2012;9:548-55. Barajas-Martinez H, Hu D, Pfeiffer R, et al. A Genetic Variant in DPP10 Linked to Inherited J-Wave Syndrome Associated with Sudden Cardiac Death by Augmentation of Kv4.3 Channel Current. Heart Rhythm 2012;9:1919-20. Burashnikov E, Pfeiffer R, Barajas-Martinez H, et al. Mutations in the cardiac L-type calcium channel associated J wave sydnrome and sudden cardiac death. Heart Rhythm 2010;7:1872-1882. Cappato R, Furlanello F, Giovinazzo V, et al. J-wave, QRS slurring, and ST elevation in athletes with cardiac arrest in the absence of heart disease: marker of risk or innocent bystander? Circ Arrhythm Electrophysiol 2010;3:305–11. Ezaki K, Nakagawa M, Taniguchi Y, et al. Gender differences in the ST segment: Effect of androgendeprivation therapy and possible role of testosterone. Circ J 2010;74:2448-2454. Gurabi Z, Koncz I, Patocskai B, et al. Cellular mechanism underlying hypothermia-induced ventricular tachycardia/ventricular fibrillation in the setting of early repolarization and the protective effect of quinidine, cilostazol, and milrinone. Circ Arrhythm Electrophysiol 2014;7:134-142. Haissaguerre M, Chatel S, Sacher F, et al. Ventricular fibrillation with prominent early repolarization associated with a rare variant of KCNJ8/KATP channel. J Cardiovasc Electrophysiol 2009;20:93-98. Haissaguerre M, Derval N, Sacher F, et al. Sudden cardiac arrest associated with early repolarization. N Engl J Med 2008;358:2016-2023. Haruta D, Matsuo K, Tsuneto A, et al. Incidence and prognostic value of early repolarization pattern in the 12-lead electrocardiogram. Circulation. 2011;123:2931-2397. Iguchi K, Noda T, Kamakura S, et al. Beneficial effects of cilostazol in a patient with recurrent ventricular fibrillation associated with early repolarization syndrome. Heart Rhythm 2013;10:604-606. Koncz I, Gurabi Z, Patocskai B, et al. Mechanisms underlying the development of the electrocardiographic and arrhythmic manifestations of early repolarization syndrome. J Mol Cell Cardiol. 2014 Mar;68:20-8. Macfarlane P., Antzelevitch C., Haissaguerre M. The early repolarization pattern: consensus paper. J Am Coll Cardiol. 2015;66:470–477. Medeiros-Domingo A, Tan BH, Crotti L et al. Gain-of-function mutation S422L in the KCNJ8-encoded cardiac KATP channel Kir6.1 as a pathogenic substrate for J-wave syndromes. Heart Rhythm 2010;7:1466-1471. Nam GB, Kim YH, Antzelevitch C. Augmentation of J waves and electrical storms in patients with early repolarization. N Engl J Med 2008;358:2078-2079. Perrin MJ, Adler A, Green S, et al. Evaluation of genes encoding for the transient outward current (Ito) identifies the KCND2 gene as a cause of J wave syndrome associated with sudden cardiac death. Circ Cardiovasc Genet. 2014;7:782–789. Priori SG, Wilde AA, Horie M, et al. Executive summary: HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Heart Rhythm 2013;15:1389– 406. Priori SG, Wilde AA, Horie M, et al. HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes: document endorsed by HRS, EHRA, and APHRS in May 2013 and by ACCF, AHA, PACES, and AEPC in June 2013. Heart Rhythm 2013;10:1932–63. Priori S.G., Blomstrom-Lundqvist C., Mazzanti A, et al. 2015 ESC guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 2015;36:2757–2759. Rosso R, Adler A, Halkin A, et al. Risk of sudden death among young individuals with J waves and early repolarization: Putting the evidence into perspective. Heart Rhythm 2011;8:923-929. Rosso R, Glikson E, Belhassen B, et al. Distinguishing “benign” from “malignant” early repolarization: The value of the ST-segment morphology. Heart Rhythm 2012; 9:225-233. Rosso R, Kogan E, Belhassen B, et al. J-point elevation in survivors of primary ventricular fibrillation and matched control subjects: Incidence and clinical significance. J Am Coll Cardiol 2008;52:1231-1238. Sinner MF, Reinhard W, Muller M, Beckmann BM, Martens E, Perz S, et al. Association of early repolarization pattern on ECG with risk of cardiac and all-cause mortality: A population-based prospective cohort study (MONICA/KORA). PLoS Med 2010;7:e1000314. Tikkanen JT, Anttonen O, Junttila MJ, et al. Long-term outcome associated with early repolarization on electrocardiography. N Engl J Med 2009;361:2529-2537. Tikkanen JT, Junttila MJ, Anttonen O, et al. Early repolarization: Electrocardiographic phenotypes associated with favorable long-term outcome. Circulation 2011; 123:2666-2673. Uberoi A, Jain NA, Perez M, et al. Early repolarization in an ambulatory clinical population. Circulation 2011;124:2208-2214. Watanabe H, Nogami A, Ohkubo K, et al. Electrocardiographic characteristics and SCN5A mutations in idiopathic ventricular fibrillation associated with early repolarization. Circ Arrhythm Electrophysiol 2011;4:874-881. Wu SH, Lin XX, Cheng YJ, Qiang CC, Zhang J. Early repolarisation pattern and risk for arrhythmia death: a metaanalysis. J Am Coll Cardiol 2013;61:645–50. Yan GX, Antzelevitch C. Cellular basis for the Brugada syndrome and other mechanisms of arrhythmogenesis associated with ST-segment elevation. Circulation 1999;100:1660-1666.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Web de Interes Sanitario
Web de Interes Sanitario
|
| Aviso legal Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional |